Examen des tests d'efficacité des désinfectants - La pertinence d'un temps de contact humide

Introduction
L'utilisation de désinfectants au titre d'agents de contrôle de la contamination microbiologique d'un environnement est une pratique bien établie, régie par des organismes de réglementation en Europe et aux États-Unis.
Le Règlement relatif aux Produits Biocides (RPB) 528/2012 [1] gouverne la commercialisation et l'utilisation des biocides en Europe. Aux États-Unis, les désinfectants chimiques sont enregistrés et réglementés par l'Agence de protection de l'environnement des États-Unis d'Amérique, en vertu de la loi fédérale sur les insecticides, les fongicides et les rodenticides (FIFRA) (40 CFR Parts 150-189) [2]. Selon la FIFRA, les désinfectants chimiques sont considérés comme des « pesticides antimicrobiens ».
Les données démontrant l'allégation d'efficacité d'un désinfectant, qu'il soit bactéricide, fongicide, sporicide ou virucide, est une exigence claire du RPB ou de l'EPA pour qu'un fabricant de désinfectant obtienne sa certification.
Au sein du secteur pharmaceutique, les utilisateurs finals doivent respecter les réglementations établissant le besoin pour eux de prouver l'efficacité d'un désinfectant. Les règlements de la FDA (Food and Drug Administration) pour le secteur pharmaceutique établissent que « L'adéquation, l'efficacité et les limites des agents désinfectants et des procédures doivent être évaluées. L'efficacité de ces désinfectants et de ces procédures doit être mesurée en fonction de leur capacité à garantir l'élimination adéquate des désinfectants potentiels sur les surfaces. » [3]. En Europe, la Commission européenne propose le même type de règles : « 4.37 Le procédé de désinfection doit être validé. Les études de validation doivent démontrer l'adéquation et l'efficacité des désinfectants dans la manière spécifique dont ils sont utilisés et doivent prendre en compte les périodes de péremption en cours d'utilisation des solutions préparées. » [4].
Méthodes de démonstration de l'efficacité
En Europe, la Norme européenne (EN) 14885:2018 [5] fournit des références imposant des méthodes de tests (normes EN) que les fabricants de désinfectants doivent utiliser pour justifier les allégations relatives à l'activité microbicide. Aux États-Unis, les règles de test de performance des produits de l'EPA, OCSPP 810.2100 [6], détaillent les méthodes de test (méthodes de l'Association of Official Analytical Chemists (AOAC)) à utiliser par les fabricants de désinfectants pour justifier les allégations relatives à l'activité microbicide.
Les types de test peuvent être répartis en deux catégories :
- Test de suspension
Exemple : EN 1276 Antiseptiques et désinfectants chimiques. Essai quantitatif de suspension pour l'évaluation de l'activité bactéricide des antiseptiques et désinfectants chimiques utilisés dans le domaine de l'agro-alimentaire, dans l'industrie, dans les domaines domestiques et en collectivité. Méthode d'essai et prescriptions (phase 2, étape 1)
EN 1650 Antiseptiques et désinfectants chimiques. Essai quantitatif de suspension pour l'évaluation de l'activité fongicide des antiseptiques et des désinfectants chimiques utilisés dans le domaine de l'agro-alimentaire, dans l'industrie, dans les domaines domestiques et en collectivité. Méthode d'essai et prescriptions (phase 2, étape 1)
Méthode officielle AOAC 955.15 Test des désinfectants contre le Staphylococcus aureus, méthode de dilution par dosage.
- Test de surface
Exemple EN 13697 Antiseptiques et désinfectants chimiques - Essai quantitatif de surface non poreuse pour l'évaluation de l'activité bactéricide et/ou fongicide des désinfectants chimiques utilisés dans le domaine de l'agro-alimentaire, le domaine industriel, les domaines domestiques et en collectivité - Méthode d'essai sans action mécanique et prescriptions (phase 2, étape 2).
Méthode officielle AOAC 961.02 Germicidal Spray Products as Disinfectants.
Les différentes méthodes de test s'appuient sur un inoculum de départ, des organismes, des réductions logarithmiques et des temps de contact spécifiques.
Pour les allégations de désinfectant en Europe, les fabricants de désinfectants effectuent généralement les tests EN, et les numéros de test EN peuvent être indiqués sur les étiquetages du produit, ainsi que les temps de contact standard spécifiés dans la méthode. Les méthodes des tests standard sont généralement utilisées car elles sont robustes, reproductibles et largement reconnues. Il peut aussi être utile aux utilisateurs finals de pouvoir se reporter aux résultats d'une méthode de test standard pour leur permettre de comparer les produits de différents fabricants.
Pour l'utilisateur final utilisant un désinfectant, les méthodes de test standard peuvent ne pas refléter réellement les conditions de leur propre salle propre pharmaceutique. De manière générale, les utilisateurs finals auront différents matériaux de surface dans leurs salles propres, différents micro-organismes présents et des conditions environnementales variables (faible niveau d'humidité, séchage rapide dû aux systèmes CVC).
L'USP (United States Pharmacopoeia) (USP) chapitre <1072> [7] apporte plus de précisions quant aux tests d'efficacité pour le secteur pharmaceutique, en établissant que « Pour démontrer l'efficacité d'un désinfectant dans un environnement de production pharmaceutique, il peut être jugé nécessaire d'effectuer les tests suivants : (1) tests de dilution (évaluation de l'efficacité des désinfectants à différentes concentrations et temps de contact par rapport à une large gamme d’organismes d’essai standard et d’isolats environnementaux) ; (2) tests de provocation de surface par désinfectants (utilisant des micro-organismes de test standard et des micro-organismes qui sont des isolats environnementaux typiques, application de désinfectants sur les surfaces à la concentration d'utilisation sélectionnée avec un temps de contact spécifié et détermination de la réduction logarithmique des micro-organismes de provocation) ; et (3) une comparaison statistique de la fréquence d'isolement des micro-organismes isolés avant et après la mise en œuvre d'un nouveau désinfectant.
Ceci est considéré comme nécessaire car les étapes critiques du procédé, telles que la désinfection des zones de traitement aseptique, comme l'exige la réglementation GMP, doivent être validées, et les exigences d'enregistrement de l'EPA n'incorporent pas la manière dont les désinfectants sont réellement utilisés dans les secteurs pharmaceutique, biotechnologique et des dispositifs médicaux.
Conformément à la directive USP, il est relativement facile d'utiliser différents micro-organismes et de tester les surfaces avec des méthodes standard. Cependant, il peut être délicat d'atteindre les temps de contact spécifiés des méthodes d'essai standard dans les conditions environnementales d'une salle propre pharmaceutique. Le taux d'évaporation d'un désinfectant essuyé sur une surface dans une salle propre, avec un taux de renouvellement de l'air élevé, peut être très différent du taux d'évaporation rencontrés dans les laboratoires. Cela soulève un certain nombre de questions quant à savoir si la surface doit être visiblement humidifiée avec un désinfectant pendant la durée spécifiée pour atteindre le bon niveau d'efficacité, et donc quelle est exactement la prescription pour le temps de contact.
Définitions du temps de contact
Afin d'établir si la présence visible d'humidité sur les surfaces pendant la durée du temps de contact (principe désigné ici comme « temps de contact humide ») doit correspondre à une exigence réglementaire, un examen des réglementations a été réalisé.
Les règlements de l'US [3],[8], l'EU GMP [4] et du Pharmaceutical Inspection Co-operation Scheme [9] ne définissent pas le temps de contact. La Pharmacopée Européenne (Ph. Eur.) n'apporte pas de précisions sur les tests d'efficacité des désinfectants. En revanche, l'USP Chapter 1072 [7] utilise fréquemment l'expression « temps de contact », mais il n'approfondit pas son sens dans la section des définitions du chapitre concerné. La norme ISO des salles propres [ISO 14644, section 5 [10]) n'apporte pas non plus de définition.
Les réglementations du secteur pharmaceutique n'apportant pas de définition claire, une recherche plus large des autres documents réglementaires applicables et des orientations reconnues de l'industrie pharmaceutique a été effectuée.
Le Royal Pharmaceutical Society/NHS Pharmaceutical Quality Assurance Committee apporte des explications sur l'application des désinfectants, établissant que « L'accumulation de quantités excessives d'agents de nettoyage et de désinfection doit être évitée. Idéalement, les surfaces doivent être sèches 1 heure après l'application. Cependant, il doit rester suffisamment de produit pour atteindre le niveau d'efficacité requis pendant le temps de contact prescrit, c'est-à-dire que la couche de désinfectant appliquée ne doit pas être trop fine » [11]. Cette déclaration induit la nécessité d'un temps de contact humide pour atteindre le niveau d'efficacité.
Les méthodes EN et AOAC ne précisent pas de « temps de contact humide ». Dans les tests de suspension, un « temps de contact humide » est toujours utilisé car le test implique l'ajout du produit désinfectant à une suspension d'organisme maintenue en solution pendant le temps de contact requis, avec un neutralisant de produit ajouté à la fin de ce temps de contact.
Cette règle n'est pas aussi claire pour les tests de surface, car la quantité de désinfectant, telle qu'elle est définie par la norme, est appliquée sur la surface à l'aide d'une pipette, sans être étalée. En raison du faible volume des pipettes et de la tension superficielle relativement élevée de la plupart des désinfectants testés, il est probable qu'un temps de contact humide soit atteint dans des conditions de laboratoire.
Le test de surface EN avec une action mécanique, l'EN 16615 [12], est la méthode de test qui est la plus proche de l'utilisation pratique des désinfectants, car elle prévoit l'action d'étalement du désinfectant sur une surface. Les informations suivantes sont fournies dans la section Conditions expérimentales concernant le temps de contact : « Les temps de contact pour des désinfectants de surface sont choisis sur la base des conditions pratiques du produit. Le temps de contact recommandé pour l'utilisation du produit relève de la responsabilité du fabricant. » On pourrait déduire de la formulation « conditions pratiques du produit » qu'elles se réfèrent à des volumes appliqués par lavage ou essuyage et taux d'évaporation, par exemple un alcool par rapport à un composé d'ammonium quaternaire, mais là encore, nous ne disposons pas d'une définition claire.
La monographie technique n°20 de la Pharmaceutical and Healthcare Sciences Society (PHSS) fournit les éléments suivants dans la Section 3-3-4 : « Les coupons sont exposés au désinfectant pendant le temps de contact de séjour/humide défini » [13]. L'humidité est ici clairement confirmée pendant le temps de contact.
La directive de l'US Center for Disease Control and Prevention (CDC) [14] fournit une définition du temps de contact dans son glossaire : « Le temps pendant lequel le désinfectant est en contact direct avec la surface ou l'objet à désinfecter. Pour la désinfection des surfaces, cette période est encadrée par l'application sur la surface jusqu'au séchage complet. » Cette définition établit aussi clairement un temps de contact humide.
La Directive sur les tests de performance des produits, OCSPP 810.2000 [15], propose la définition suivante pour le temps de contact. « Le temps de contact utilisé pour les tests d'efficacité doit être inférieur ou égal au temps de contact identifié sur l'étiquette du produit. Si le temps de contact est différent de la plage identifiée dans la méthode d'essai ou la prescription privilégiée, il est recommandé de consulter l'agence avant le test et une modification de l'approche standard peut être nécessaire. Dans la majorité des cas, une modification visant à disposer d'une période d'exposition plus longue est limitée aux considérations pratiques des principes d'utilisation (p. ex. période d'exposition > 10 minutes pour un produit susceptible de s'évaporer de la surface traitée dans un délai de 10 minutes). Identifiez et justifiez clairement les modifications des méthodes dans le protocole des essais. Pour les produits liquides ou pulvérisés contenant des ingrédients actifs volatils, où le produit est appliqué sur une surface dure non poreuse, le temps de contact maximal peut être déterminé en inspectant visuellement l'évaporation pendant la période de contact proposée. » Encore une fois, cet énoncé implique qu'un temps de contact humide est attendu.
Le rapport technique du PDA 70 [16] propose un glossaire avec la définition suivante : « Le temps minimum d'attente où un assainissant, désinfectant, sporicide doit être en contact intégral (humide) avec la surface à traiter pour être efficace. » Cette définition évoque clairement un temps de contact humide.
Le Guide for Disinfectant Use de Pharmig [17] propose le texte suivant : « Une évaporation plus rapide du désinfectant peut intervenir sur des surfaces chaudes ou lorsque la surface traitée est soumise à un faible taux d'humidité ou une circulation de l'air élevée, des conditions souvent rencontrées dans les opérations des salles propres. » Cette déclaration induit la nécessité d'un temps de contact humide pour atteindre le niveau d'efficacité.
À partir de l'examen ci-avant des publications les plus respectées du secteur pharmaceutique, la nécessité d'un temps de contact humide apparaît plus clairement.
Il n'est pas inconcevable qu'il y ait une continuité de l'efficacité d'un désinfectant une fois que la surface est visiblement sèche, car l'action se déroule au niveau cellulaire. La première étape de la destruction microbienne est l'absorption de l'ingrédient actif du désinfectant par la cellule. Il convient donc de considérer qu'il y a deux « périodes » en jeu au cours de la désinfection (Figure 1).
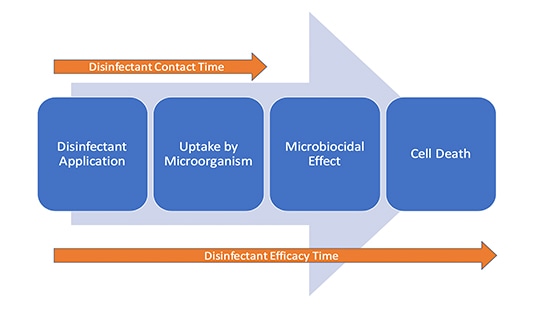
Conclusion
Pour démontrer l'efficacité, un fournisseur de désinfectant est tenu de conduire des tests standard dans des conditions susceptibles d'être reproduites et à partir desquelles il définira un temps de contact. Le temps de contact peut s'avérer utile pour l'utilisateur final dans le choix du désinfectant approprié.
Un utilisateur final valide aussi l'efficacité du désinfectant selon les conditions d'utilisation au niveau de ses installations, notamment en définissant un temps de contact adapté aux conditions réelles.
La majorité des organisations de recommandations pharmaceutiques définissent le temps de contact comme un temps de contact humide.
Il existe peu d'études publiées permettant d'en savoir plus sur la performance des désinfectants une fois que les surfaces sont visiblement sèches. Il est également impossible d'effectuer des mesures pratiques, l'utilisateur n'ayant pas la possibilité d'observer les cellules mortes, à titre de référence.
Pour faciliter les tests de l'utilisateur final dans les conditions correspondant à ses installations, on l'encourage à mesurer le temps d'évaporation des désinfectants lors de l'application, en utilisant des techniques de routine (essuyage/lavage à la frange) et d'utiliser ce temps de contact pour des études en laboratoire.
Références :
- Réglementation (UE) n° 528/2012 du Parlement européen et du Conseil européen du 22 mai 2012 relatif à la mise sur le marché et l'utilisation de produits biocides
- Titre 40 du Code of Federal Regulations (40 CFR) Subchapter E Pesticide Programs Parts 150-189
- Règlement de la FDA pour l'industrie - Sterile Drug Products Produced by Aseptic Processing, Current Good Manufacturing Practice (2004)
- Volume EudraLex 4 Directives de l'UE concernant les bonnes pratiques relatives à la production de médicaments à usage humain et vétérinaire Annexe 1 Fabrication de produits médicamenteux stériels (Version v.12 publiée en février 2020)
- EN 14885:2018 Antiseptiques et désinfectants chimiques. Application des normes européennes pour les antiseptiques et les désinfectants chimiques
- Directives concernant les tests de performance des produits de l'EPA, OCSPP 810.2100, Sterilants, Sporicides, and Decontaminants, Guidance for Efficacy Testing, [EPA 712-C-17-003]
- United States Pharmacopoeia (USP) chapter 1072 Disinfectants and Antiseptics
- The Code of Federal Regulations CFR Title 21 - Food and Drugs: Parts 1 to 1499
- GUIDE PICS SUR LES BONNES PRATIQUES DANS LE DOMAINE DES PRODUITS MÉDICAMENTEUX ANNEXES PE 009-14
- ISO 14644 Part 5 Salles propres et environnements contrôlés associés - Part 5: Operations, 2004
- Royal Pharmaceutical Society. Quality Assurance of Aseptic Preparation Services: Standards. Part A 5th Edition 2016
- EN 16615 Antiseptiques et désinfectants chimiques - Méthode d'essai quantitative pour l'évaluation de l'activité bactéricide et levuricide sur des surfaces non poreuses avec une action mécanique utilisant des lingettes dans le domaine médical (essai sur site 4) - Méthode et prescriptions de l'essai (phase 2, étape 2)
- Pharmaceutical and Healthcare Sciences Society (PHSS) Technical Monograph 20 Bio-Contamination characterisation, control, monitoring and deviation management in controlled / GMP classified areas
- Center for Disease Control and Prevention (CDC) Guideline for Disinfection and Sterilization in Healthcare Facilities (2008)
- Product Performance Test Guideline, OCSPP 810.2000, General Considerations for Testing Public Health Antimicrobial Pesticides, Guidance for Efficacy Testing, [EPA 712-C-17-002]
- Parenteral Drug Association (PDA) Technical Report No. 70. The Fundamentals of Cleaning and Disinfection Programs for Aseptic Manufacturing Facilities (2015).
- Guide Pharmig pour les désinfectants et leur usage dans l'industrie pharmaceutique (2017)
- West AM, Teska, PJ, Oliver HF : Il n'y a pas d'efficacité bactéricide supplémentaire des lingettes désinfectantes enregistrées par l'Environmental Protection Agency après le séchage de la surface ou au-delà du temps de contact sur l'étiquette. Am J Infect Control 2019; 47: 27-32



